"الصحة" تحذر من علاجات لمضاعفاتها الخطيرة على المرضى
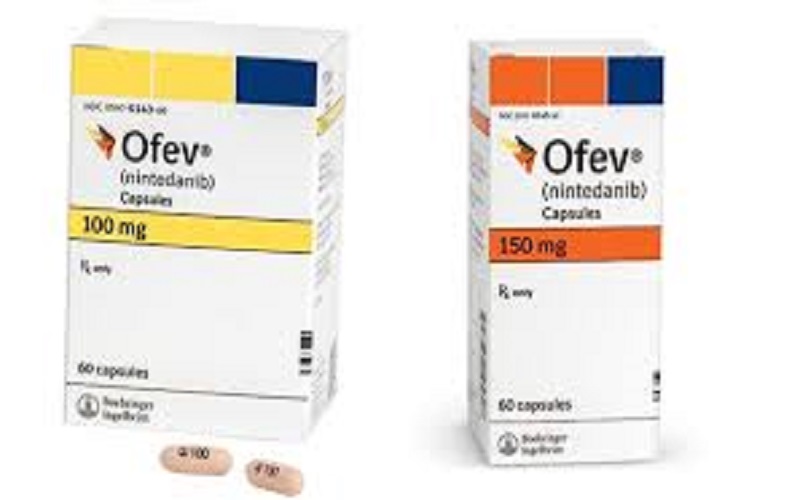
أصدرت وزارة الصحة ووقاية المجتمع 3 تعاميم إدارية لإضافة تحذير على مستحضر صيدلاني لعلاج التليف الرئوي، قد يتسبب بحدوث إصابات خطيرة في الكبد. وتعليق تسجيل مستحضر صيدلاني آخر لعلاج السكري لعدم مطابقة بعض التشغيلات للمواصفات المعتمدة، والتحذير من مكمل غذائي ومقوي جنسي لاحتوائه على مادة دوائية غير معلن تسبب الانخفاض الحاد في ضغط الدم.
وأكد سعادة الدكتور أمين حسين الأميري الوكيل المساعد لسياسة الصحة العامة والتراخيص رئيس اللجنة العليا لليقظة الدوائية، حرص الوزارة الدائم على متابعة جميع التحذيرات والتوصيات الواردة من شركات تصنيع الدواء والهيئات العالمية للدواء وذلك في إطار الجهود الحثيثة، التي تبذلها الوزارة في سبيل تحقيق نظم وتدابير الحماية المجتمعية من مخاطر التزييف الدوائي، والحرص على تحقيق الوقاية والسلامة للمرضى والمجتمع، وفق استراتيجيتها نحو بناء أنظمة الجودة والسلامة العلاجية والصحية والدوائية، وفق المعايير العالمية وتعزيز السلامة واليقظة الدوائية.
حيث أشار الدكتور الأميري إلى قيام الشركة المصنعة Boehringer Ingelheim بتبليغ الوزارة عن إضافة تحذير على المستحضر الصيدلاني Ofen (nintedanib) والذي يستخدم لعلاج التليف الرئوي، قد يتسبب بحدوث إصابات خطيرة في الكبد. وعليه يجب على ممارسي الرعاية الصحية فحص ترانس امينيز والبيليروبين في بداية العلاج خلال أول 3 أشهر من العلاج دورياً وبعد ذلك في كل زيارة للمريض أو كما هو محدد سريرياً كما ينصح بتقليل الجرعة أو أخذ العلاج المناسب عند ارتفاع الترانس امينيز، علمأ أن المنتج مسجل في إدارة الدواء بوزارة الصحة ووقاية المجتمع.
وأوصت الوزارة ممارسي الرعاية الصحية أخذ الحيطة والحذر عند صرف الدواء المذكور أعلاه لمرضاهم، علماً أن الصنف الدوائي آمن للاستخدام ولم يتم سحبه من الأسواق وهذه التحذيرات تضاف للنشرة الدوائية فقط. وفي حال حدوث أي أعراض جانبية يرجى ملئ الاستمارة الخاصة بالآثار الجانبية للدواء ADR والمتوفرة على موقع الوزارة أو الاتصال على العناوين هاتف: 2301448 -04 أو فاكس2301947 -04 أو البريد الالكتروني pv @moh.gov.ae .
و ذكر الأميري أنه تقرر إصدار تعميم بتعليق تسجيل المستحضر الصيدلاني Metaphage 500mg tablet للشركة المصنعة الكويتية السعودية، بناء على ما ورد للوزارة من مجلس الصحة لدول مجلس التعاون بخصوص تعليق تسجيل المنتج المذكور والمستخدم لعلاج مرض السكري، وذلك بناء على نتائج دراسات التحليل المخبرية لعدد من التشغيلات، والتي بينت عدم مطابقتها للمواصفات المعتمدة . كما تم دراسة التكافؤ الحيوي وتبين تصميم الدراسة أنه غير مناسب، والذي لا يتطابق مع الشروط المعتمدة للدراسات المتعلقة بنوعية هذه الأدوية.
وعليه أوصت اللجنة الخليجية المركزية للتسجيل الدوائي بتعليق المستحضر وعمل دراسة تكافؤ حيوي للمستحضر تحت إشراف الهيئة العامة الغذاء والدواء بالسعودية، علماً أن المنتج مسجل في وزارة الصحة ووقاية المجتمع وعليه تقرر؛ تعليق تسجيل المستحضر على أن يتم الانتهاء من التحقق من جودة المنتج، ويجب على المورد سحب جميع التشغيلات للمستحضر من القطاعين الصحي العام والخاص، وعلى جميع ممارسي الرعاية الصحية عدم استخدام المنتج المذكور إن وجد لديهم، ووعلى جميع الصيدليات التوقف عن صرفه وإعادته للمورد.
و أردف د أمين أن إدارة الغذاء والدواء الأمريكية أبلغتنا بخصوص المنتج Rhin 69 Extreme 5000 capsulate الذي يستخدم كمكمل غذائي ومقوي جنسي للرجال، حيث أظهرت التحاليل احتواءه على مادة دوائية غير معلن عنها اسمها Tadalafil علما أنها تسبب الانخفاض الحاد في ضغط الدم قد يصل لمستوى خطير ويمكن أن تشكل خطرا على المصابين بأمراض القلب والسكري أو ارتفاع الدهون وخاصة الذين يتناولون أدوية تحتوي على النترات، لذلك أصدرنا تعميم للمنشآت الصحية والصيدلانية الحكومية والخاصة لاتخاذ الإجراءات لسحب المنتج من الأسواق ومنع تداوله واستيراده في حال توفره، علما أن المنتج غير مسجل في إدارة الدواء بوزارة الصحة ووقاية المجتمع.
![]() تابعوا آخر أخبارنا المحلية والرياضية وآخر المستجدات السياسية والإقتصادية عبر Google news
تابعوا آخر أخبارنا المحلية والرياضية وآخر المستجدات السياسية والإقتصادية عبر Google news



